发布时间:2024-03-15
2024年3月15日,《eLife》杂志在线发表了题为《Deciphering the genetic interactions between Pou4f3,Gfi1,and Rbm24 in maintaining cochlear hair cell survival》的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)刘志勇研究组完成。研究团队通过一系列基因敲除、敲入以及转基因小鼠模型,揭示了毛细胞维持存活过程中三个重要调控基因Pou4f3、Gfi1以及Rbm24之间的相互作用关系,确定了Pou4f3而非Gfi1正向调控Rbm24基因的表达,并鉴定出3个之前未知的Rbm24的增强子。同时,该研究也证明这3个增强子是在耳蜗毛细胞有活性,可以用于制备毛细胞特异的AAV,用于耳聋基因治疗。该研究通过扎实的体内遗传学实验数据,首次阐明了毛细胞存活必需的新基因Rbm24与其它两个关键基因Pou4f3与Gfi1的相互作用关系,为毛细胞存活的分子机制提供了新的见解,并为耳聋治疗提供了新的思路与方法。
根据WHO公布的数据,目前有超过5%的世界人口,即4.3亿人(4.32亿成年人和3400万儿童)正遭受听力丧失的影响,预估到2050年,患有听力障碍的人数将达到7亿人。哺乳动物耳蜗内仅存数量有限的毛细胞,它们是听觉系统中的重要组成部分。毛细胞能够将声波转化为神经信号,最终传递给大脑,从而感知声音。然而,有很多耳毒性因素如基因突变、噪音、药物、衰老等会导致毛细胞死亡。毛细胞损伤是导致感音性耳聋的主要原因,一旦毛细胞受损,它们便无法再生,从而致使听力发生不可逆转的损伤。因此,探索维持毛细胞存活的分子机制对于预防听力丧失、以及耳聋治疗至关重要。
Pou4f3、Gfi1以及Rbm24都是维持毛细胞存活所必需的基因。有趣的是,Pou4f3或Gfi1基因缺失的毛细胞虽然最初可以形成,但随后会迅速死亡。相比之下,Rbm24基因缺失的毛细胞死亡时间明显滞后。此外,这3个基因在耳蜗中的时空表达模式非常相似。然而,关于Pou4f3、Gfi1和Rbm24之间的转录级联调控机制目前知之甚少。该研究通过构建一系列基因敲除小鼠模型,结合免疫组化分析,发现Rbm24在Pou4f3-/-毛细胞中的表达被完全抑制(图1 A-B’’’),但在Gfi1-/-毛细胞中的表达不受影响(图1 C-D’’)。此外,Pou4f3和Gfi1在Rbm24-/-毛细胞中的表达也不受影响(图1 E-F’’)。这些研究结果表明:Pou4f3是Rbm24的上游调控必须基因,而Gfi1与Rbm24互不依赖。
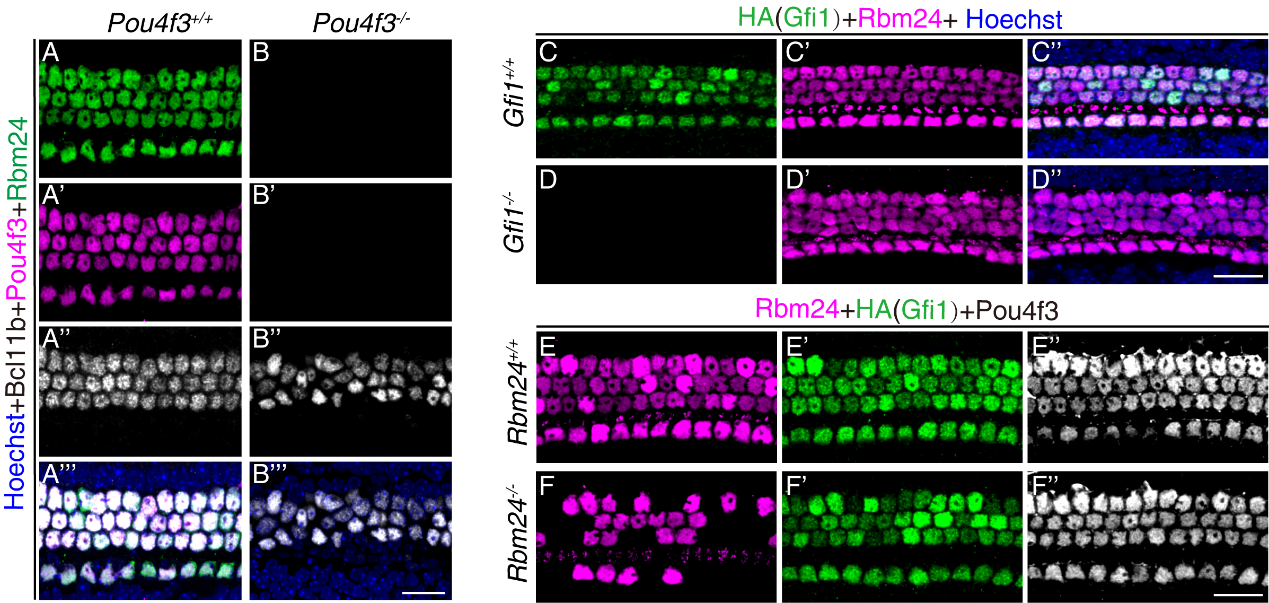
图1. Pou4f3而非Gfi1是Rbm24的上游调控基因。A-B’’’. Rbm24在Pou4f3-/-毛细胞中的表达完全受到抑制,Bcl11b是外毛细胞的标记基因;A-A’’’. Pou4f3野生型小鼠中Rbm24正常表达;B-B’’’. Pou4f3敲除小鼠中,毛细胞正常,但Rbm24表达完全消失。C-D’’. Rbm24在Gfi1-/-毛细胞中表达不受影响,HA是融合在Gfi1末端的标签蛋白,用于表征Gfi1蛋白表达情况;与Gfi1野生型毛细胞类似(C-C’’),Gfi1敲除的毛细胞中Rbm24的表达未发生改变(D-D’’)。E-F’’. Pou4f3与Gfi1的表达不受Rbm24缺失的影响。
进 一步,通过分析小鼠耳蜗毛细胞ATAC-seq与Pou4f3的Cut&Run数据,发现Rbm24基因组上存在3个能被Pou4f3结合的顺式DNA调控序列。研究人员通过构建转基因小鼠模型,确定了这3个顺式DNA调控序列是Rbm24的增强子,其诱导的绿色荧光报告基因只在毛细胞内表达。最后,研究人员试图通过回补Rbm24,来缓解或阻止Pou4f3缺失导致的毛细胞退化死亡,结果发现:仅靠外源性的Rbm24并不能缓解Pou4f3缺失小鼠中毛细胞的丢失。这个结果提示:Pou4f3-Rbm24的级联调控通路只是Pou4f3的下游调控通路之一,其他维持毛细胞存活的Pou4f3下游基因有待后续研究。
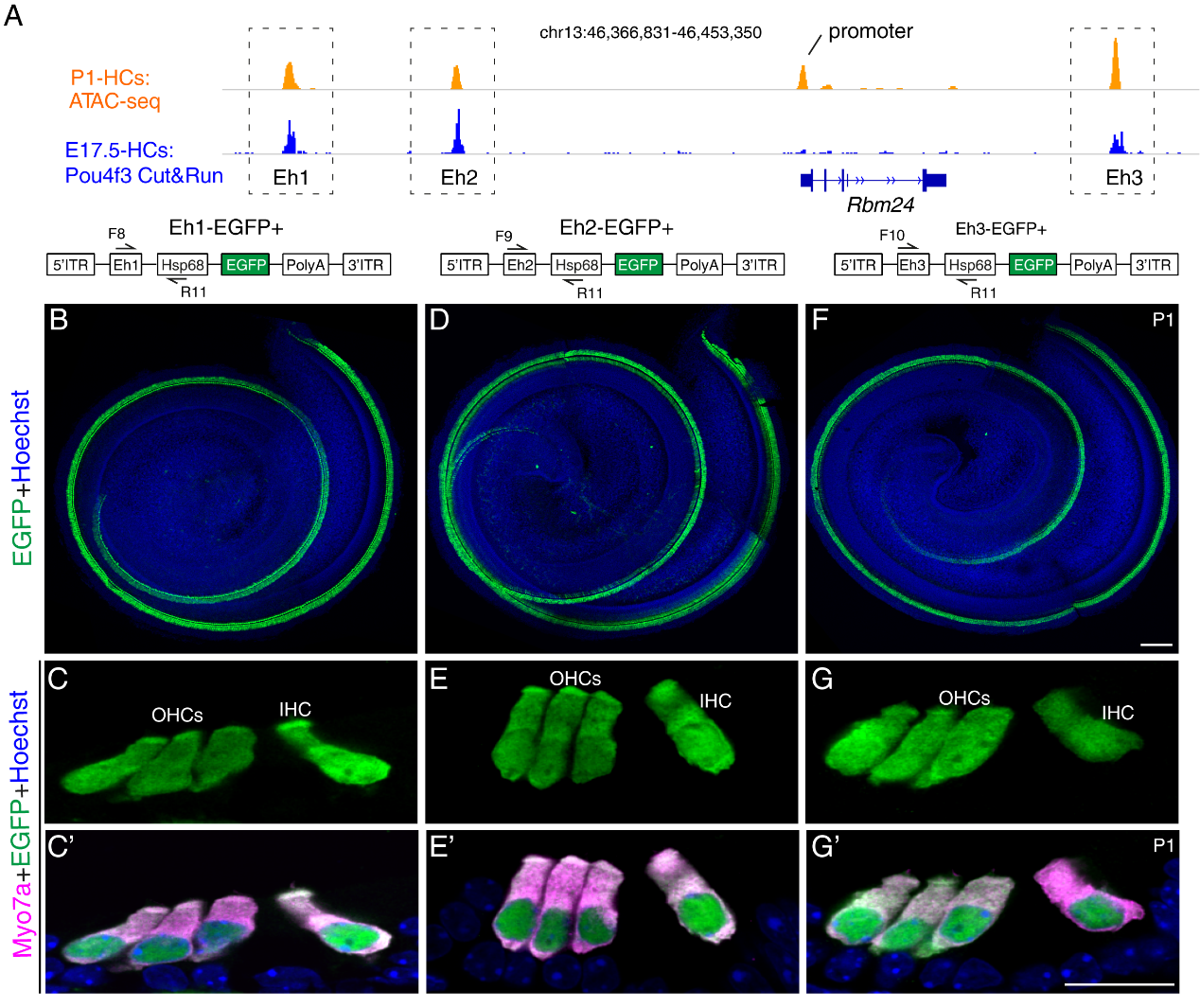
图2. Pou4f3通过结合Rbm24的3个增强子来调控Rbm24的表达。A. Pou4f3能够与Rbm24基因3个远端的顺式调控位点结合,A图上半部分与下半部分分别是IGV软件可视化毛细胞ATAC-seq(染色体可及性),以及Pou4f3的Cut&Run(转录因子结合DNA)的结果。B-G’. Rbm24三个远端的调控元件(Eh1,Eh2和Eh3) 均能单独驱动EGFP在耳蜗毛细胞中特异性表达;IHC是内毛细胞;OHC是外毛细胞;Myo7a是毛细胞的标记基因。
总之,该研究为毛细胞存活的分子和遗传机制提供了新的见解,其中新发现的3个Rbm24的增强子对于耳聋基因治疗有很高的潜在临床应用价值,可用于开发耳蜗毛细胞靶向基因治疗的新型AAV工具。
中国科学院脑科学与智能技术卓越创新中心刘志勇研究员为本论文的通讯作者,刘志勇组博士研究生王广琴为本论文的第一作者,博士研究生顾云鹏也为本项目作出了贡献。中国科学院脑智卓越中心光学平台和啮齿类实验动物平台提供了重要技术支持。该研究获得了国家自然科学基金委员会、科技部、上海市科委和中国科学院的资助。
 附件下载:
附件下载: