

发布时间:2020-04-16

东方网记者解敏4月8日报道:今天,《细胞》期刊在线发表了题为《通过CRISPR-CasRx介导的胶质细胞向神经元的转分化治疗神经性疾病》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室杨辉研究组完成。该项研究将为未来众多神经退行性疾病的治疗提供一个新的途径。
我们之所以能看到外界绚烂多彩的世界,是因为我们的眼睛和大脑中存在一套完整的视觉通路,而连接眼睛和大脑的神经元就是视神经节细胞。作为眼睛和大脑的唯一一座桥梁,视神经节细胞对外界的不良刺激非常敏感。研究发现很多眼疾都可以导致视神经节细胞的死亡,急性的如缺血性视网膜病,慢性的如青光眼。人类的神经系统包含成百上千种不同类型的神经元细胞。在成熟的神经系统中,神经元一般不会再生,一旦死亡,就是永久性的。神经元的死亡会导致不同的神经退行性疾病,常见的有阿尔兹海默症和帕金森症。此类疾病的病因尚不明确且没有根治的方法,因此对人类的健康造成巨大威胁。
帕金森病传统疗法大多只能减缓神经元死亡的速度,而对于已经逝去的神经细胞则无力回天,可谓治标不治本。但随着科技的进步,人们发现只要适当调控某些基因,就能让细胞出现所谓的转分化现象,也就是从一种细胞变成另一种细胞。比如降低Ptbp1基因,就有一定的概率在体外将其他类型细胞转换成神经元。传统方法一般只能在细胞培养皿里面实现对特异类型神经元的转分化,因此如何在体内安全地实现神经元的转分化来治疗不同的神经退行性疾病就成了临床上迫切需要解决的问题。
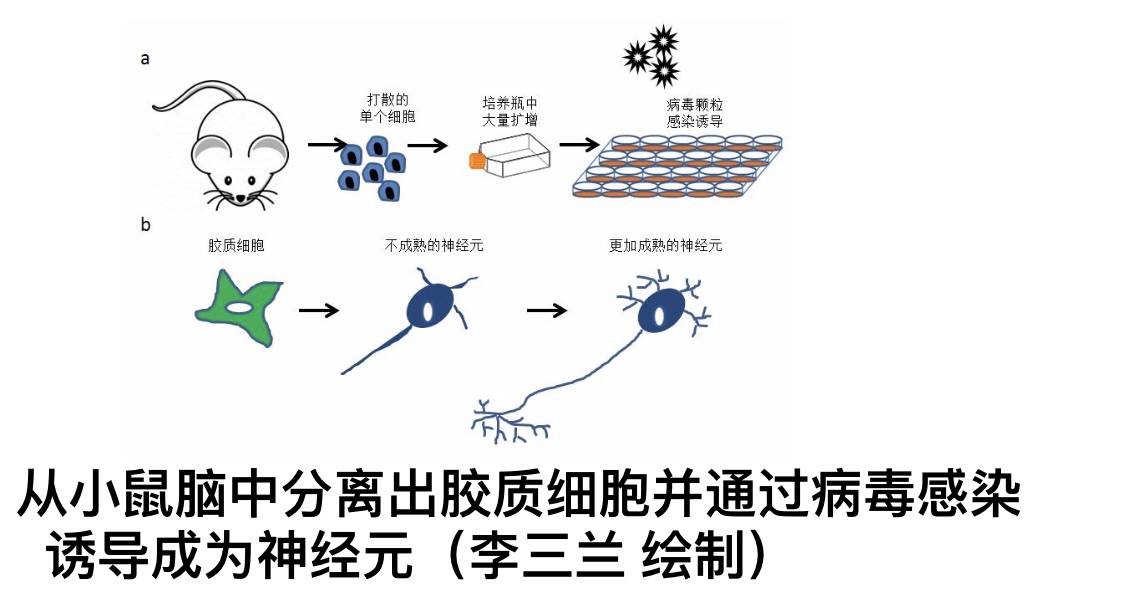
中国科学院脑科学与智能技术卓越创新中心杨辉研究组的此项研究很好地解决了这一问题。几年前,该团队就设计了一套基于改造版CRISPR/Cas9的基因激活系统。传统上,CRISPR/Cas9是一种用来实现靶向切割制定DNA序列的系统,不过研究团队将这个系统中的一部分氨基酸序列做了修改,使之只能精确靶向但不能切割,同时还给它加了一套可以激活基因的外挂,能够精确激活指定基因表达的系统。这套系统的优势在于,它只会对内部存在的基因进行调控,大大降低了细胞转分化的临床风险。
最近,该团队又利用最新开发的一套新的CRISPR-CasRx系统,该系统能特异性靶向和编辑RNA。他们把这套系统装载进了一个叫做腺相关病毒的载体当中,这些病毒就像是专门为细胞设计的“快递盒”,可以把这个基因调控系统精确无误地递送到制定的细胞当中,包括活体动物体内的细胞,这样就解决了传统技术只能在培养皿中纸上谈兵的问题。这一次,研究团队把这套系统设计成了可以专门降低胶质细胞中Ptbp1表达的模式,他们首先将这套系统用于治疗视神经节死亡的小鼠,这些小鼠由于眼中的视神经节细胞死亡,因此来自眼睛的视觉信号难以传递给大脑,只能成为睁眼瞎。
而在给小鼠眼内注射这套系统后大约一个月,研究者就能在视网膜视神经节细胞层发现了由穆勒胶质细胞转化而来的不同种类的视神经节细胞,并且转化而来的视神经节细胞可以像正常的细胞那样对光刺激产生反应,瞎掉的小鼠也因此恢复了光明。
于是研究团队又对患有帕金森病的小鼠测试了这项疗法,结果将带有定向抑制Ptbp1系统的AAV注射进小鼠的纹状体(帕金森病中死亡的多巴胺神经元就是把多巴胺释放到这个部位发挥功能)后,果然检测到这个区域的一部分星形胶质细胞转化成了多巴胺神经元,而小鼠也逐渐恢复了比较正常的运动能力。

研究人员同时告诉记者,虽然该项研究在实验室里取得了重要进展,但是要将研究成果真正应用于人类疾病的治疗,还有很多工作要做。人类的视神经节细胞能否再生?帕金森患者是否能通过该方法被治愈?这些问题有待全世界的科研工作者共同努力去寻找答案。
 附件下载:
附件下载: 