

发布时间:2025-04-29
2025年4月30日,CELL期刊在线发表题为“Neural-activity-regulated and glia-mediated control of brain lymphatic development”的研究论文。该工作由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)杜久林课题组完成,首次发现脑膜淋巴系统发育的大脑调控机制:神经活动通过特定胶质细胞亚群——slc6a11b+辐射状星形胶质细胞(Radial astrocyte, RA)动态调控关键因子Vegfc的表达,并在脑膜ccbe1+成纤维细胞跨组织协作下,精密控制脑膜淋巴内皮细胞(mural lymphatic endothelial cell, muLEC)的发育模式。此项研究突破了传统脑膜淋巴发育的理论框架,发现了“神经-胶质-成纤维细胞-淋巴”动态调控轴,为神经-免疫系统互作研究领域提供了新认知。
1787年,意大利解剖学家Paolo Mascagni在其著作《人体淋巴管系统图谱》中首次描述了人脑膜淋巴系统。直到2015年,芬兰赫尔辛基大学Alitalo团队与美国华盛顿大学Kipnis团队分别“重发现”,才系统描述了脑膜淋巴系统的结构与相关功能。近十年研究表明,脑膜淋巴系统作为大脑的“排污网络”,通过清除代谢废物、运输免疫细胞等维持大脑内稳态。然而,其发育调控机制一直是个谜——这套精密系统如何形成?何种细胞或信号主导其特异性在脑膜上的生长?
研究团队充分利用脊椎动物斑马鱼在体长时间成像的优势,结合多种基因操作、神经活动调控等手段,发现上调大脑神经活动(如视觉诱发等)显著增强位于软脑膜muLEC的发育,抑制神经活动(如视觉剥夺等)则导致muLEC发育受损。以淋巴系统发育所必须的因子Vegfc为线索,研究团队在脑内鉴定出特异性表达Vegfc的胶质细胞亚群——slc6a11b+ RAs(图I)。这些细胞延伸出纤维直达脑膜表面,是脑内Vegfc的主要来源,其缺失导致muLEC无法正常发育,而上调其Vegfc信号则显著增强muLEC发育(图II)。同时,slc6a11b+ RAs的活动及其Vegfc的表达水平均受到神经活动的调节(图III)。研究团队进一步发现,slc6a11b+RAs分泌的Vegfc前体(pro-Vegfc)需要位于脑膜的成纤维细胞分泌的CCBE1的协同作用,方可转化为成熟形式的Vegfc(mVegfc);这种跨组织间的协作将mVegfc的分布精确限制在脑膜上,确保了muLEC仅分布于脑表面,避免侵入脑实质(图IV)。
该工作表明,大脑不仅是神经信息处理中心,也是自身微环境的“协调者”。神经活动通过特定的胶质细胞亚群动态调节脑膜淋巴内皮的发育,揭示了一条全新的“神经-胶质-成纤维细胞-淋巴”调控轴,解释了大脑如何根据功能需求动态调节其淋巴网络构建,为研究脑-免疫互作提供了新框架;同时,该发现也诠释了脑膜淋巴系统只定位于脑膜而不侵入脑实质的原因所在。未来,干预这一调控网络可为了解脑膜淋巴系统在神经退行性疾病等中的作用提供新视角,并为研发潜在的干预手段提供新途径。
中国科学院脑智卓越中心杜久林研究员和李佳副研究员(中国科学院青促会会员)、瑞金医院尚寒冰主任医师为该论文的共同通讯作者。李佳副研究员是该论文的第一作者,瑞金医院刘明剑和华山医院杜文杰为共同第一作者。中国科学院脑智卓越中心彭小兰和訾化星、瑞金医院邓浩做出了重要贡献。该研究获得国家科技创新2030重大专项、科技部重点研发计划、国家自然科学基金、赛诺菲—中国科学院上海生命科学研究院优秀青年人才奖励基金、上海市自然科学基金及中国科学院青促会的资助。
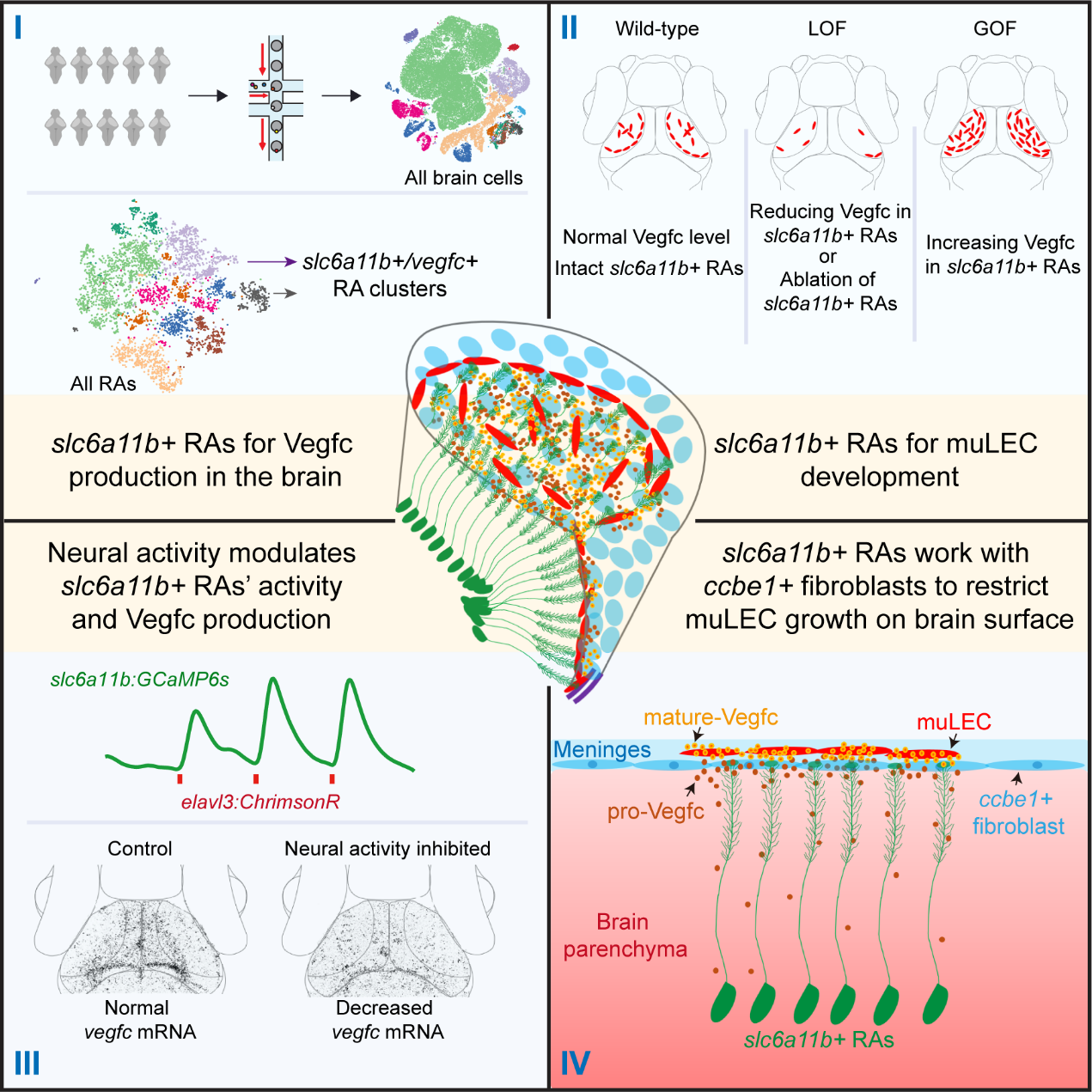
图I-图IV: 神经活动通过特定胶质细胞亚型调控脑膜淋巴系统发育
图I: slc6a11b+ RAs是脑内Vegfc的主要来源
图II: slc6a11b+ RAs产生的Vegfc调控脑膜淋巴内皮细胞的发育
图III: 神经活动调控slc6a11b+ RAs的活动及其Vegfc的表达水平
图IV: slc6a11b+ RAs与ccbe1+成纤维细胞协同作用,控制淋巴内皮细胞在脑膜生长
 附件下载:
附件下载: 