

发布时间:2020-04-14
2020年4月8日,《Journal of the American Chemical Society》期刊在线发表了题为《近红外电压纳米探针用于实时监控小鼠和斑马鱼神经活动》的研究论文,报道了中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室杜久林研究组与中国科学院上海硅酸盐研究所施剑林、步文博研究组的一项合作研究成果。该研究开发了一种可用近红外光激发的电压荧光纳米探针,成功监测了斑马鱼和小鼠脑中神经元膜电位的动态变化。
群体神经元活动的在体检测是揭示神经系统功能机制的关键。目前,神经元钙离子荧光成像是主要的手段之一。然而,相比于神经脉冲信号,钙离子荧光信号的动力学相对较慢,且很难推断出与之对应的神经脉冲的频率和数量。因此,神经科学界迫切期望能开发出对细胞膜电位变化敏感、有高信噪比的纳米粒子或荧光分子探针,从而实现高时空分辨率、大范围神经元集群电活动的活体检测。现有的荧光电压探针只能用紫外或可见光激发,因其在活组织中易于吸收和散射而只能应用于大脑浅层。相比于可见光或紫外光,红外光(750 nm - l000 nm)在生物组织中穿透能力更强,穿透深度可达厘米量级,被称为“生物组织的光学窗口”。因此,如何研发高灵敏的、并可用近红外光激发的电压敏感探针已成为目前国际神经科学领域重点攻克的技术难关之一。
稀土元素掺杂的上转换纳米颗粒(UCNPs)是一类近红外光激发,紫外、可见光多重发射的反斯托克斯发光纳米材料。由于其深组织穿透度、低背景荧光、多重发射的特性,已在生物成像与活体诊疗的应用中获得广泛关注。在该工作中,研究人员设计和制备了一种基于UCNPs的电压敏感探针。首先将UCNPs固定在细胞膜上,然后将六硝基二苯胺(DPA)嵌入细胞膜磷脂双分子层。在细胞静息状态下,带负电荷的DPA在细胞膜外侧富集,UCNP与DPA之间距离在10 nm以内,因此形成发光共振能量转移体系(FRET),UCNPs发光被DAP吸收,检测到的光信号较弱。当细胞去极化后,DPA在电场作用下在细胞膜内侧富集,UCNP与DPA之间距离超过10 nm,FRET效应消失,从而恢复UCNPs的发光。
为验证该电压纳米探针在神经元电活动检测中的优势,研究人员应用该纳米探针分别检测了斑马鱼前脑神经元的嗅觉反应和小鼠新皮层神经元膜电位振荡随麻醉深度的变化。神经元的电活动具有丰富的动态性,而以往开发的基于荧光蛋白电压探针的信噪比较低,大都需要平均多次才能得到清晰的感觉反应。更严重的是,此类探针极易荧光淬灭,因此可记录时间较短,严重限制了其实用性。应用新开发的电压纳米探针,研究人员研究了斑马鱼前脑神经元对食物刺激的反应。在近红外光激发下,单次施加该食物刺激即可显著增强神经元的荧光信号,并可在连续数次刺激下稳定记录。进一步地,得益于UCNPs较低程度的淬灭,活体记录时间可长达30分钟,远高于目前的蛋白分子探针。
哺乳动物神经元膜电位的阈下振荡,反映了动物个体的脑状态及其变化。在深度睡眠和麻醉状态下,脑状态主要是慢波;在动物趋于清醒时,慢波减弱甚至消失,取代以高频电活动。基于钙离子成像所反映的神经活动难以体现这种阈下膜电位振荡,研究人员在小鼠初级体感皮层中注入电压纳米探针,并考察了戊巴比妥麻醉不同深度下的神经元阈下膜电位活动。在深度麻醉状态下,纳米探针发光存在低频振荡现象,提示此状态下阈下膜电位以慢波为主。通过机械刺激小鼠尾巴提高其清醒水平后,纳米探针发光的低频振荡先减弱,高频成分相对增强,在10分钟后恢复至原有水平。此现象说明纳米探针的发光强度可真实反映脑电成分的相应变化。
综上所述,该工作为设计可用近红外光激发的电压敏感探针提供了全新思路,为探究深层活体组织中神经活动开辟了实时动态监测的新方法。
该项工作由杜久林组刘佳男博士后、张荣伟副研究员和尚春峰副研究员在杜久林研究员以及上海硅酸盐研究所的施剑林研究员、步文博研究员的共同指导下完成。杜久林研究组的张俞博士、许兵博士以及蒲慕明研究组的冯芸也做了重要贡献。该工作得到国家自然科学基金委员会、科技部、中科院和上海市的资助。
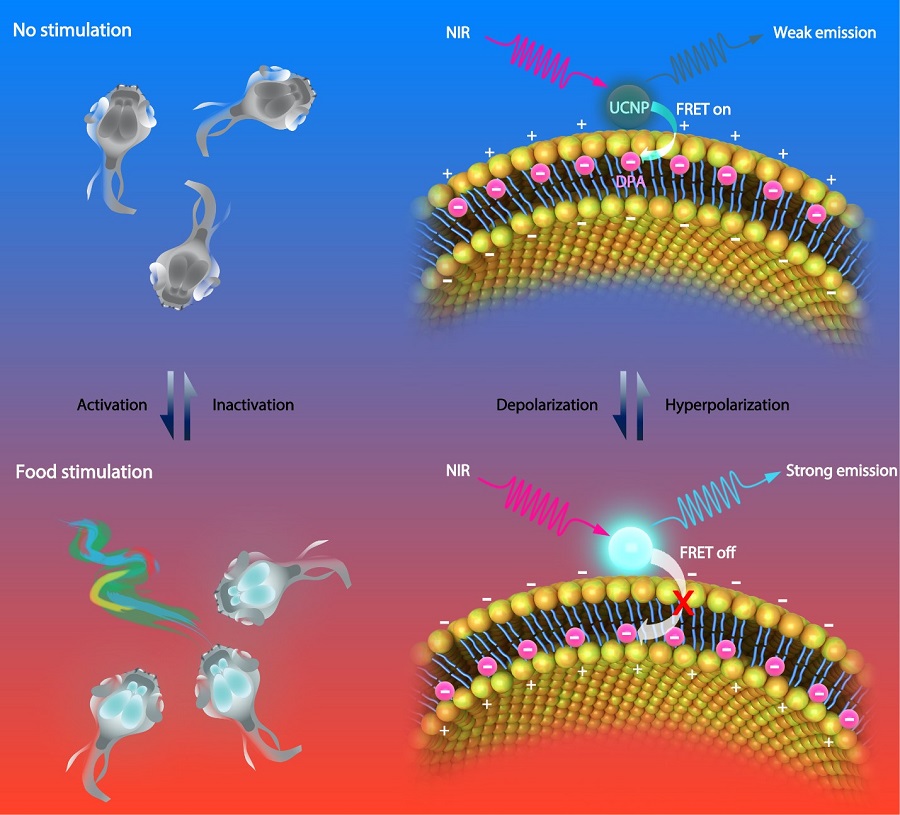
图注:电压纳米探针的设计及其感应机理。首先,UCNPs固定在神经元细胞膜上。其次,将六硝基二苯胺(DPA)嵌入细胞膜磷脂双分子层。在神经元静息状态下,带负电荷的DPA在细胞膜外侧富集,UCNP与DPA之间形成发光共振能量转移体系(FRET),UCNPs发光被DAP吸收,检测到的光信号弱。当神经元去极化后,DPA在电场作用下在细胞膜内侧富集,FRET效应减弱,从而恢复UCNPs的发光。
 附件下载:
附件下载: 