

发布时间:2018-06-15
近日,由福建医科大学附属第一医院神经内科陈万金教授、王柠教授团队与中国科学院神经科学研究所、脑科学与智能技术卓越创新中心、神经科学国家重点实验室熊志奇研究员团队合作,发现并鉴定了MYORG是原发性家族性脑钙化症(Primary Familial Brain Calcification,PFBC)的新致病基因。6月14日,神经科学领域杂志《Neuron》以“Biallelic mutations in MYORG cause autosomal recessive primary familial brain calcification”为题在线发表了这一成果。
脑钙化病是一种影响广泛的神经障碍性疾病,在老年人中发生率高达20%,由于其发病机制不清楚,临床上缺乏有效的治疗手段。原发性家族性脑钙化症以双侧基底节、小脑或其他脑区病理性钙化沉积为特征,其临床症状主要包括类帕金森氏症的进行性运动障碍、神经精神症状、构音障碍和认知障碍等。自2012年华中科技大学刘静宇教授发现首个PFBC致病基因SLC20A2以来, 其他实验室后续又发现XPR1、PDGFRB、PDGFB等致病基因。然而仍有50%以上的家族性患者的遗传因素尚未明确,且基于目前的四个基因也难以较好的构建PFBC的分子细胞病理机制。
面对这一问题,陈万金教授团队与山东大学齐鲁医院、福建医科大学附属漳州市医院等多家医疗单位合作,近年来收集了数十个PFBC家系,通过全外显子测序、Sanger测序等方法,发现了6个隐性PFBC家系与MYORG 基因突变共分离。MYORG 基因,又名 KIAA1161或NET37,位于染色体9p133上,编码含有714个氨基酸的蛋白,是糖基水解酶31家族的成员,其功能与相关信号通路研究鲜有报道。
通过与中科院神经科学研究所熊志奇研究员团队合作,发现Myorg基因特异地表达在S100b阳性的星形胶质细胞中。随后,在新构建的Myorg-GFP模型小鼠上也证实了这一点。在8-9月龄的Myorg基因敲除的小鼠脑内,观察到双侧对称性脑钙化结节的发生。通过扫描电镜结合X射线能谱仪分析,发现钙结节的主要成分为钙、磷、氧等,与临床病人脑钙化的元素组分高度相似,证明MYORG常染色体隐性功能缺失型突变是重要的PFBC致病基因。
此前发现的PFBC四个基因皆为显性遗传,而该工作所发现的MYORG基因在PFBC中呈隐性遗传,在所有的PFBC家系中,MYORG突变比例达11%,为本病第二常见致病基因。有趣的是,MYORG突变在隐性家系中所占比例高达50%。在机制层面,之前研究认为脑钙化主要由周细胞及血脑屏障破坏所致,而本研究首次表明胶质细胞也是脑钙化发生的关键因素。
我国拥有丰富的遗传病临床资源,临床与基础的密切合作有助于高效地取得原创性成果。正是基于这一共同理念,福建医科大学的陈万金、王柠和吴志英教授(现任职浙江大学附属第二医院)早在2011年就与熊志奇团队合作鉴定了发作性运动诱发性运动障碍(PKD)的首个致病基因PRRT2。随后数年,从分子、细胞、环路和行为层面,采用小鼠和食蟹猴模型进行了系统性的研究,初步架构了PKD发生的分子和环路机制,为开发治疗PKD的新方法提供了重要参考。
本研究由福建医科大学附属第一医院神经内科姚香平博士、神经所程学文副研究员和福建医科大学博士研究生王冲、赵淼为共同第一作者,在陈万金教授、熊志奇研究员和王柠教授的指导下共同完成。福建医科大学附属第一医院的多位医生、医学生在样本采集、测序分析等实验上提供了帮助。福建医大附属漳州医院陈雪娇博士,山东大学附属齐鲁医院赵玉瑛博士提供了部分珍贵的临床样本。美国北岸大学健康学院徐剑锋教授,神经所杨辉研究员,上海科技大学范高峰教授提供了指导,神经所光学成像平台、小鼠动物房和非人灵长类研究平台(苏州)在小鼠制作、饲养和成像方面提供了大力帮助。本研究得到了国家自然科学基金、中国科学院战略性先导科技专项、科技部发展项目、国家临床重点专科建设项目的大力资助。
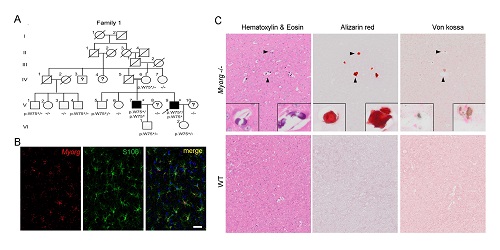
图注:A. MYORG基因突变隐性遗传的家系一; B. 在2月龄小鼠大脑皮层中,Myorg基因与胶质细胞的标记分子S100b共标;C. 在9月龄Myorg基因纯合敲除的小鼠大脑内,钙沉积物染色阳性。
 附件下载:
附件下载: 