

发布时间:2018-05-22
5月21日,《Developmental Cell》期刊在线发表了题为《Tild-CRISPR Allows for Efficient and Precise Gene Knockin in Mouse and Human Cells》的研究论文,该研究由中科院神经科学研究所、脑科学与智能技术卓越创新中心杨辉研究组与山东大学附属生殖医院、上海交通大学医学院附属仁济医院陈子江教授课题组合作完成。该研究设计了一种新型基因靶向整合策略Tild-CRISPR,它可以在小鼠和人的细胞中实现高效精确的基因敲入。Tild-CRISPR不仅适用于高效地构建小鼠动物模型,同时为研究体内的基因功能以及开发潜在的基因疗法提供新思路。
CRISPR/Cas9介导的基因编辑方法极大地促进了体内和体外的转基因靶向整合。传统的同源重组(HR)介导的整合策略在动物胚胎和组织中效率低下。非同源末端接合(NHEJ)和微同源臂介导的末端接合(MMEJ)策略只能在某些系统内提高效率。该研究团队之前的研究结果表明,以同源臂介导的末端接合(HMEJ)为基础的策略可以在小鼠胚胎以及小鼠体内实现高效地靶向整合。但是实现高效地构建条件性基因或大片段基因敲入小鼠模型,以及在人胚胎上实现高效靶向整合等仍存在技术壁垒。
在本工作中,研究团队基于CRISPR/Cas9系统,设计了一种新的靶向整合策略Tild-CRISPR (Targeted Integration with Linearized dsDNA-CRISPR),通过PCR扩增或者精确酶切获得含有800bp同源臂的转基因供体与Cas9 mRNA以及single-guide RNA一起注射到小鼠受精卵中。相比现有的靶向策略,该方法在注射的小鼠胚胎中表现出最高的敲入效率,并成功地在6个不同的位点分别获得了从0.8 kb到6.0 kb 不同长度外源基因的敲入小鼠。同时,与HR或HMEJ介导的方法相比,Tild-CRISPR在子宫内电转实验中显示了更强大的体内DNA 敲入能力。更重要的是,在人类胚胎中,Tild-CRISPR方法的基因敲入效率比HR介导的方法高12倍,这极大地促进了人类胚胎发育的研究以及疾病突变的修复。
综上所述,该工作建立了一种新的基因靶向整合策略Tild-CRISPR,通过体外PCR扩增或者精确酶切获得含有800bp同源臂的线性转基因供体,可以在小鼠和人的细胞中实现高效的DNA靶向整合,为研究体内的基因功能和开发潜在的基因疗法提供了新的思路。
该项工作由神经所助理研究员姚璇博士、博士研究生王兴与仁济医院生殖医学中心章美玲博士在神经科学研究所灵长类疾病模型研究组杨辉研究员与山东大学附属生殖医院、上海交通大学医学院附属仁济医院陈子江教授的指导下完成。课题组其他成员积极参与,并得到生化细胞所孟飞龙研究员、神经所实验动物平台、分子细胞平台与光学成像平台的大力协助。本工作得到国家科技重大专项,上海市科学技术委员会项目,国家自然科学基金会,上海市辅助生殖和生殖遗传重点实验室,国家研究和发展计划等项目的资助。
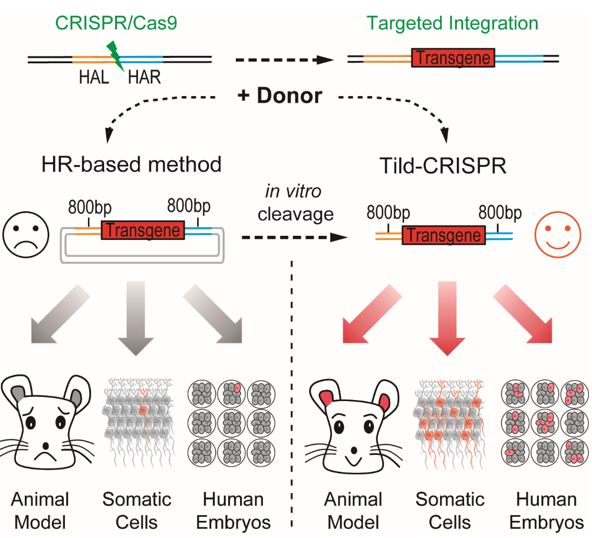
研究模式图:Tild-CRISPR,通过体外PCR扩增或者精确酶切获得含有800bp同源臂的线性转基因供体,可以在小鼠胚胎,小鼠大脑以及人胚胎中实现高效的DNA靶向整合。
 附件下载:
附件下载: 