

发布时间:2017-04-24
4月21日,《细胞研究》期刊在线发表了中科院神经科学研究所、中科院脑科学与智能技术卓越创新中心、神经科学国家重点实验室杜久林研究组题为《神经元通过释放含有miR-132的外泌体调节脑部血管完整性》的研究论文。该研究发现,神经元通过释放外泌体向脑血管内皮细胞中运输神经元高表达的miR-132,进而通过靶向eef2k维持VE-cadherin的高表达,从而起到调节脑血管完整性的作用。该工作揭示了神经元调节脑血管发育的新机制,并首次发现了外泌体介导的这种神经-血管调节方式。
组成大脑毛细血管的血管内皮细胞通过形成紧密连接,以及和周围的周细胞和星形胶质细胞相互作用,形成血脑屏障。血脑屏障精细控制血液和脑组织的物质交换,维持脑内微环境的稳定。脑血管完整性的破坏会导致或加剧一系列的神经系统疾病。在脑血管发育领域中,之前的研究发现脑血管发育相对于外周血管而言,存在很多的特异性,但我们对于神经系统是如何调节脑血管发育及血脑屏障的形成还不清楚。
为了研究神经系统是如何调节脑血管发育的,研究人员运用斑马鱼为模型,首先检测了神经元高表达的miR-132在脑血管发育中的作用。发现下调或突变miR-132破坏了斑马鱼脑血管完整性,并伴随着严重的脑内出血。
为了检测脑血管完整性破坏的细胞和分子机制,研究人员检测了对于维持脑血管完整性至关重要的血管内皮细胞间的连接蛋白、胞吞转运及周细胞的覆盖,发现血管内皮细胞连接蛋白(VE-cadherin)和它的胞内作用蛋白β-catenin参与了miR-132对脑血管完整性的破坏,而胞吞转运和周细胞并不参与其中。通过特异性下调神经元的miR-132,发现神经元的miR-132对于维持脑血管完整性是必须的。
重要的是,研究发现上调或下调神经元中miR-132的水平会导致血管内皮中miR-132水平发生相应的改变,同时特异性下调血管内皮细胞中的miR-132的水平也导致VE-cadherin表达的下降及脑血管完整性的破坏。进一步地,研究人员结合斑马鱼活体和离体培养哺乳动物细胞的实验,发现神经元释放含有miR-132的外泌体进入血管内皮细胞,进而调节血管内皮细胞miR-132的水平。而抑制外泌体的分泌会导致血管内皮细胞miR-132水平的降低以及脑血管完整性的破坏。
最后,通过microarray检测发现真核生物延长因子2激酶(eukaryotic elongation factor 2 kinase, eef2k)是miR-132的直接下游靶基因,并介导了miR-132对VE-cadherin的表达及脑血管完整性的调节。
该工作发现了miR-132在脑血管发育中新功能,并揭示了外泌体作为脑血管完整性的神经调节的一个新的载体。该发现为之后神经元外泌体介导的神经血管相互作用的研究提供了新的方向。
这项工作是在杜久林研究员指导下,主要由博士研究生许兵和张俞合作完成,并得到杜旭飞、李佳、訾化星、卜纪雯、严勇和中科院自动化所韩华研究员的技术支持。该工作受到国家自然科学基金(31325011、31500849)、国家万人计划、上海领军人才、上海市优秀学术带头人(14XD1404100)和扬帆计划(14YF1406600)、中国博士后研究基金(2015T80458)等项目的支持。
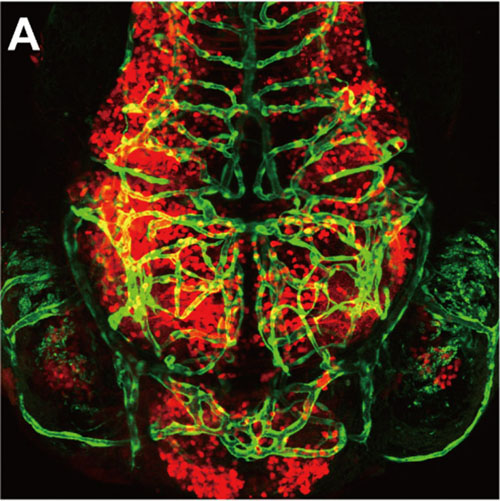
A) 3天斑马鱼幼鱼脑血管网络的共聚焦图像,其中eGFP(绿色)标记血管内皮细胞,tdTomato(红色)标记神经元。
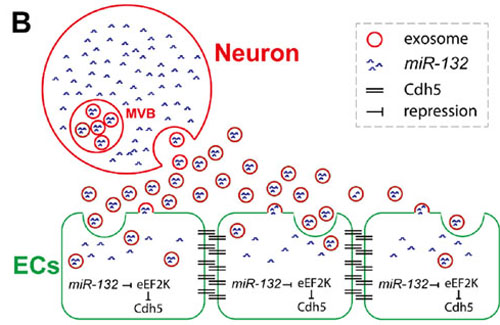
B) 机制模型:神经元释放含有miR-132的外泌体,并被脑血管内皮细胞吞噬。在血管内皮细胞中miR-132通过靶向并抑制eef2k的表达,进而上调Cdh5的表达,最终促进脑血管完整性的发育。
 附件下载:
附件下载: 