

发布时间:2021-06-28
6月28日,《神经元》期刊在线发表了题为《人源GluN1-GluN2A NMDA受体的门控机制和一个全新小分子结合位点》的研究性论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心的竺淑佳研究组完成。该研究解析了一系列人源NMDA(N-methyl-D-aspartic acid,即N-甲基-D-天冬氨酸)受体GluN1-GluN2A亚型与不同小分子化合物结合的高分辨率冷冻电镜的结构,并探究了受体在不同小分子结合下的门控机制,同时也发现了一个全新的小分子结合位点。该研究丰富了NMDA受体的神经药理学特性,为深入理解NMDA受体结构和功能之间的联系提供了新的分子机制。

NMDA受体作为一类重要的兴奋性离子型谷氨酸受体,在神经系统发育形成与突触可塑性中发挥重要功能。NMDA受体通常由两个结合甘氨酸的必需亚基GluN1和两个结合谷氨酸的可变GluN2亚基(2A-2D)组成异源四聚体离子通道蛋白。其功能异常与中枢神经系统和精神疾病(如抑郁症、精神分裂症、帕金森病和阿尔兹海默症等)有密切的关联性。这些神经和精神疾病给患者及病人家属带来极大的痛苦,是亟需解决的重要临床难题。因此,深入研究NMDA受体在生理状态下的构象与功能,并揭示全新的小分子结合位点,对于靶向NMDA受体功能异常的新药研发是至关重要的。
本研究通过冷冻电镜解析了一系列高分辨率的处于不同生理状态下GluN1-GluN2A NMDA受体结构(下图)。首先,研究者引入一对半胱氨酸交联,使受体处于更激活状态,并发现GluN1亚基和GluN2A亚基的配体结合域二聚体有向内旋转的构象变化,验证了之前的功能及动力学模拟研究。
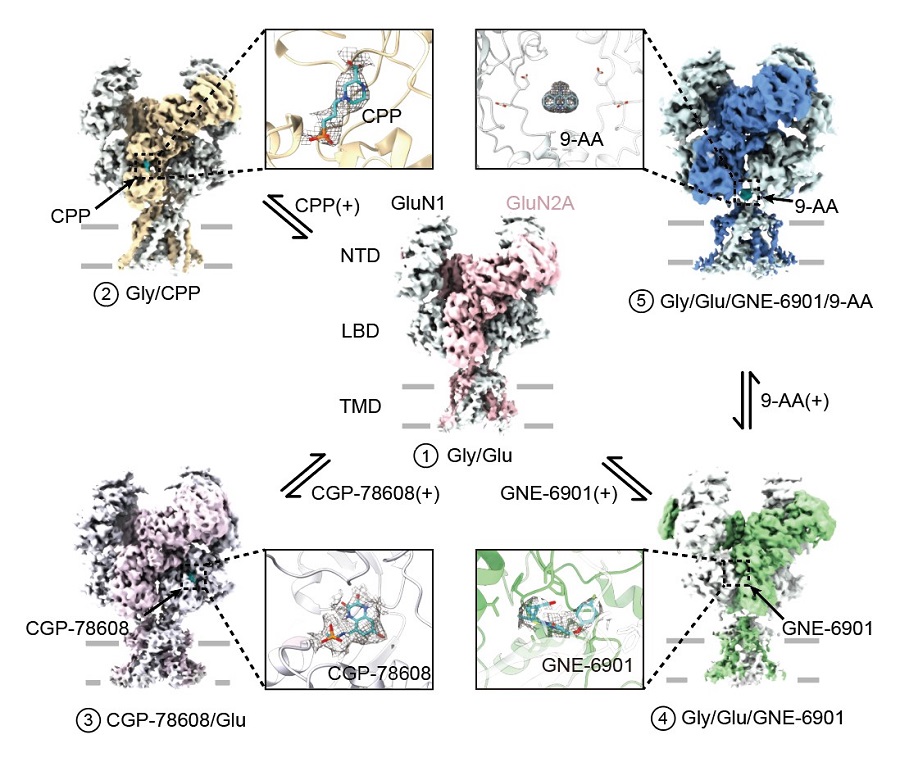
图1 | 冷冻电镜解析不同状态下人源GluN1-GluN2A NMDA受体
同时,研究人员分别使用高亲和力的GluN2A亚基的竞争性抑制剂CPP和GluN1亚基的竞争性抑制剂CGP-78608来模拟的受体抑制关闭的状态。与激动剂结合的受体结构对比发现,配体结合域整体处于被打开的构象。随着配体结合域的构象打开,铰链区失去对门控通道结构域的牵引,进而使得门控通道处于关闭状态。为研究变构调节机制,研究人员进一步使用GluN2A亚基特异的正性变构调节剂GNE-6901与GluN1-GluN2A蛋白结合。之前的研究发现该小分子通过作用在由GluN2A亚基组成的NMDA受体上,可以促进CA1锥体神经元的兴奋性突触后电位进而改善脑部功能。冷冻电镜解析的GNE-6901结合的NMDA受体结构分析发现,小分子结合在GluN1与GluN2A亚基配体结合域间二聚体中引起构象变化,使得受体的门控通道进一步处于相对开放的构象。
最后,研究人员在NMDA受体上首次发现一个全新的小分子结合位点。研究人员使用开放通道抑制剂9-AA与受体结合并解析了三维结构,发现9-AA小分子处于受体跨膜区门控通道的连接域处,完全不同与此前功能实验预测的传统通道抑制剂结合位点。为了验证小分子的作用机制,研究者通过电生理实验证实了在GluN1和GluN2A的连接域处的一对谷氨酸的突变会影响小分子在受体上的作用,进而给小分子在此处的结合提供了功能验证。这项工作丰富了NMDA受体的结构和药理学研究,完整阐释了其作为离子通道的门控机制,为药物设计、筛选及新药研发提供了重要的理论依据(图2)。
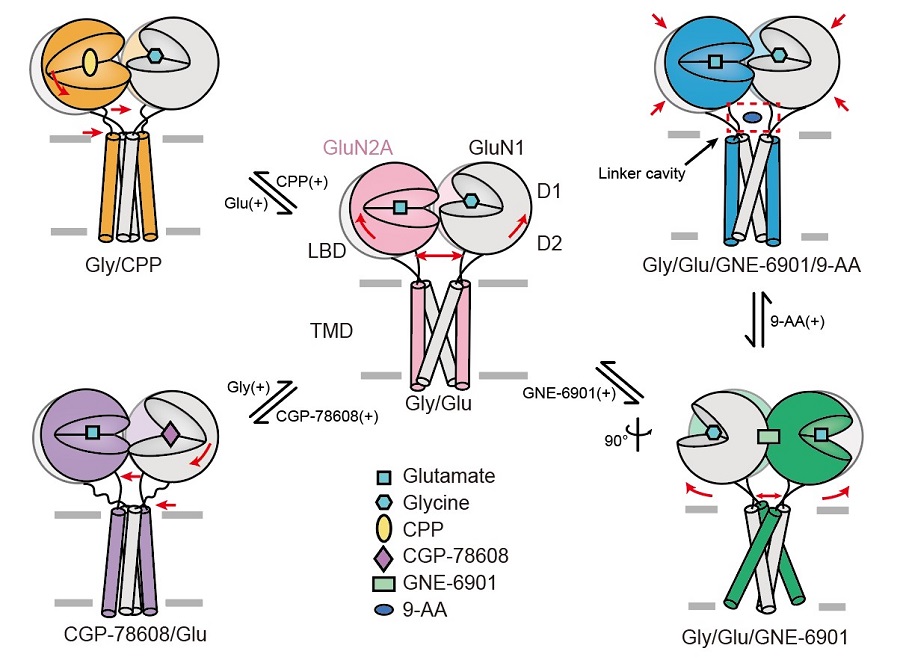
图2 | GluN1-GluN2A NMDA受体的门控机制
该工作由中国科学院脑智卓越中心突触蛋白结构和功能课题组的博士研究生王涵在竺淑佳研究员的指导下完成,实验室研究生吕诗云,黄雪晶,研究实习员张金宝,潘祎杰作出重要贡献。研究内容也得到法国巴黎高等师范学校Pierre Paoletti教授合作指导。中科院脑智卓越中心,浙江大学、生物物理所及上海科技大学的冷冻电镜平台为本研究的数据采集提供大力支持。该研究得到国家自然科学基金委、科技部、中国科学院,上海市科委及欧洲研究委员会的资助。

 附件下载:
附件下载: 