发布时间:2022-05-20
从小婴儿咿呀学语、蹒跚学步到嬉笑怒骂、经历生活敲打的酸甜苦辣,无一不需要大脑的参与。大脑作为情绪、思想、行动等的载体,是宇宙中最迷人也最复杂的研究对象。如果说“想象”存在停靠的位置,那么大脑毫无疑问便是起源。然而,记忆是如何形成并存储的,意识是什么,情绪是如何产生的——这些日常生活中我们习以为常的事件的发生背后都隐含着神经科学领域的重要科学问题。
从17世纪胡克通过显微镜第一次观察到植物细胞到19世纪施莱登、施旺建立起细胞学说,人们逐渐认识到:细胞是生物体结构和功能的基本单位。然而,由于缺乏使神经系统“显形”的有效染色方法,人们对神经系统的基本组成知之甚少。当时科学界普遍认可约瑟夫·格拉赫(Joseph von Gerlach)基于他的氯化金染色法提出的网状学说,即像人体的血管网络一样,神经组织是由神经细胞融合而成的连续网络。1873年,卡米洛·高尔基(Camillo Golgi)发明重铬酸银染色法(后称高尔基染色法),可以使少量神经元(1-5%)染色,从而使完整的神经元形态暴露于世人眼中——然而高尔基对此并不怀疑网状学说的正确性。1887年,圣地亚哥·拉蒙·卡哈尔(Santiago Ramón y Cajal)第一次接触到高尔基染色的神经组织样本,并大受震撼——此后他基于改良的高尔基染色方法对大量脑组织切片进行细致的观察,向网状学说发起挑战,指出神经细胞是相互独立的单位。
在卡哈尔一系列发现的基础上,1891年,瓦尔岱耶(Wilhelm von Waldyer)正式提出“神经元”的概念,并建立起神经元理论。1906年,为表彰高尔基和卡哈尔在神经系统结构的解析中做出的杰出贡献,他们二人共同获得诺贝尔生理学或医学奖。即使是在颁奖礼上,二人仍针锋相对,为自己的学说进行辩论。而直到电子显微镜发明,这一学术争论才真正一锤定音——神经元学说成为现代神经科学发展的基本理论。卡哈尔由此被认为是现代神经科学之父。

卡米洛·高尔基与圣地亚哥·拉蒙·卡哈尔(左)和卡哈尔绘制的神经元(右)
如今我们已经知道,正是大脑中小小的神经元通过突起相互联系组成了复杂的神经网络,处理来自体内外的纷繁复杂的信息,严密监控、指导着机体的正常运转。据估计,哺乳动物的大脑有数以百万计的细胞,人脑拥有860亿个神经元。DNA 双螺旋结构发现人之一、诺贝尔生理学或医学奖获得者Crick和Jones在给 Nature 的评论中写道:“我无法忍受我们没有绘制出人类大脑的连接图。没有它,很难有希望能了解我们的大脑是如何工作的。”——我们要想理解大脑的工作原理,绕不开对于大脑结构的精细解析。而神经元作为研究大脑功能的基本单位,对于其结构的认识无疑有助于理解大脑的信息组织架构——正像是唯有明白了电视机内部每个元件如何连接组织,我们才能掌握电视机如何播放图像、声音,如何接受外界的指令。小鼠作为生命科学领域的明星模式动物,解析它的全脑神经元结构特征自然便成为了科学家们首先关注的科学问题。因此,正如同卡哈尔一样,我们面临的问题是选择一项合适的技术实现对神经元的可视化。
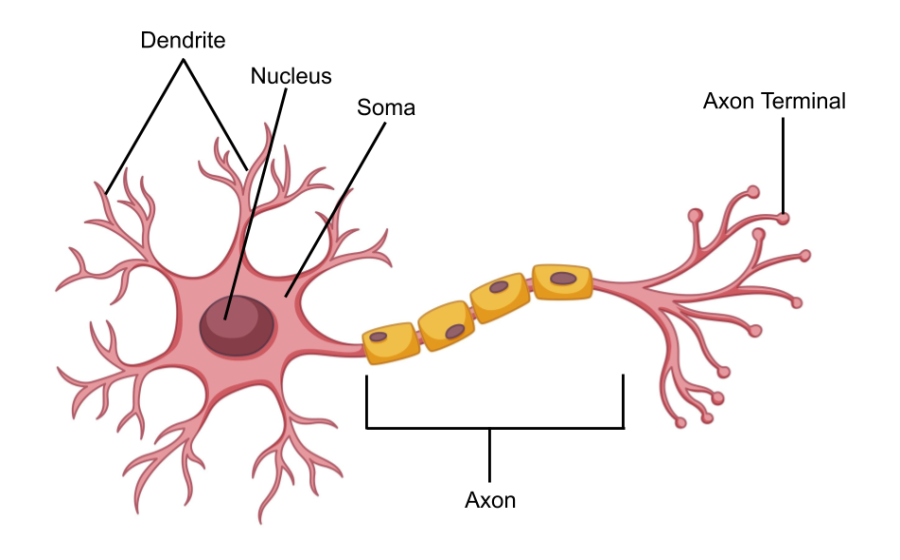
神经元结构图
一个典型的神经元由胞体、树突、轴突构成。其中,树突粗而密集,位于胞体附近,接收其他神经元的信息输入。轴突则又长又细,可以延伸很远,轴突的末端可以形成突触前末梢,与另一个神经元的树突或者胞体形成突触连接,通过释放突触递质参与神经元之间的信息传递。神经元胞体通常为十几到几十微米不等,轴突长度却可以达到厘米级别,而其直径却仅为0.2-0.5微米。也就是说,为了能看清神经元的轴突走向,我们至少应该选择达到微米级的成像手段。目前,电镜作为成像分辨率最高的技术手段,可以实现纳米级别的成像,也已经应用到小动物如线虫、果蝇的神经元连接图谱的研究中——但是仅仅小鼠的脑体积就相当于线虫脑体积的一千万倍,更不用说脑容量更大的灵长类了。考虑到小鼠全脑范围成像所需成本、时间及产生的庞大的数据量——电镜成像很明显不适用。为了满足在全脑尺度上解析神经元连接图谱,科学家们将视线投向光学成像。
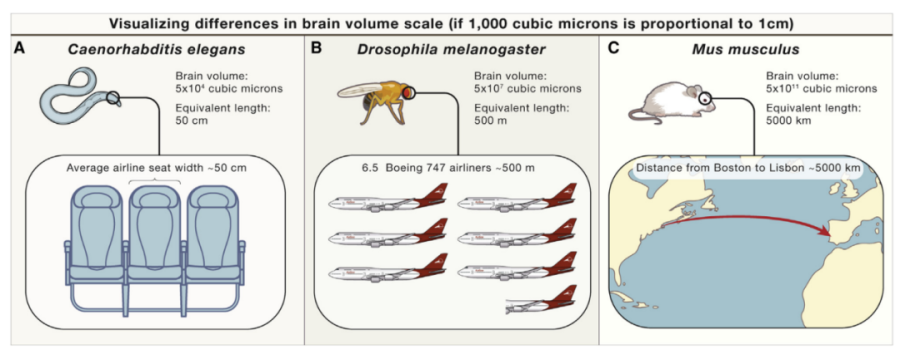
线虫、果蝇、小鼠脑容量比较
2010年,华中科技大学骆清铭教授团队利用自主研发的显微光学切片断层成像(micro-optical sectioning tomography, MOST)技术成功实现小鼠全脑的高分辨率图谱绘制。他们利用改良的高尔基染色方法对鼠脑进行染色,并利用Spurr树脂对鼠脑进行包被。为了绕过光学成像的成像深度限制,他们创造性地提出了“边切片边成像”的策略。在成像时,金刚石刀片将固定好的小鼠脑子切成厚度为1微米、宽450微米的条状组织薄片,随后由光学显微镜对切好的薄片进行成像。历经242小时,完成对小鼠全脑的成像,通过后期的数据处理,可以将切片图像拼接最终重构形成三维立体的小鼠全脑图谱。
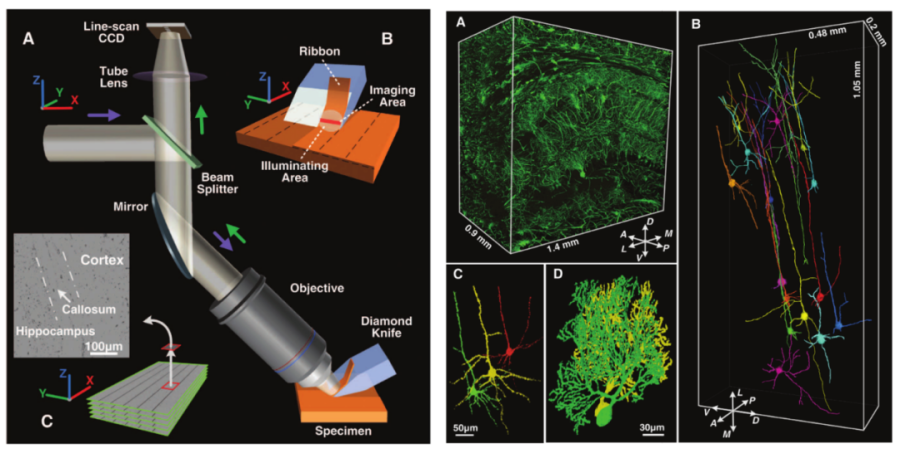
MOST技术成像原理示意图(左)及小鼠脑成像结果图展示(右)
虽然MOST技术实现了小鼠全脑的神经元成像,但是在实际研究中科学家们更倾向于利用荧光蛋白标记某些神经元而不是利用染色的方法对全脑神经元进行染色。因此发展可以实现荧光成像的MOST技术即fMOST(fluorescence micro-optical sectioning tomography)则成为他们下一阶段的目标。
与染色剂所需的明场成像不同,荧光蛋白由于对温度、pH更加敏感,稍有不慎就可能导致信号淬灭,对于成像的要求也就更高了。为此,他们改进了鼠脑在成像前的处理和包被方法,最大限度地减少荧光信号的丢失,同时保证组织薄片具备合适的硬度,避免组织过薄发生变形影响成像效果。为了能准确获得神经元胞体及突起的在大脑中的定位信息,他们也利用大脑中的标志性位置结合MRI和小鼠标准脑图谱进行了相应的计算和转换,从而完成对神经元形态的标注——就像我们身处于一个陌生的城市,根据手机地图可以轻松定位到当前的位置——二维的标准脑图谱就相当于手机地图,我们结合自己看到的地标性建筑实现对手机地图和所处实景的对应。
2015年,科学家们应用线台扫描共聚焦(stage-scanning line confocal microscopy)进一步提高了成像速度。2016年,他们基于一种称为全脑定位系统(Brain-wide Positioning System,BPS)的全自动显微成像方法,通过在成像时同时染出细胞结构标志物,实现在单细胞分辨率水平的精准定位细胞结构。2021年,骆清铭团队提出一种高清晰度、高通量的光学层析显微成像新方法——线照明调制光学层析成像(Line illumination microscopy, LiMo),在快速高分辨率光学成像时能显著提高背景抑制能力极大地提高了成像质量,提升了数据存储与分析的效率。

fMOST成像过程展示
据报道,仅为攻克脑样本制备的难题,骆清铭教授团队耗费了三年时间。技术的研发涉及到生物、光学、机械、计算机数据处理等多学科领域的合作交叉。经过十几年的研发与优化,fMOST技术具备高分辨率、高通量、高清晰度的优点,自动成像快速高效且准确地获取神经元的形态信息,为后续重构、分析全脑范围神经元形态打下坚实的基础,已经成为研究解析全脑介观神经元连接图谱的一大利器,在全世界范围内广泛应用。
和人类社会相似类似,每个人都是一个独立的个体,但又由于一些相似的特征而被分成各个群体。神经元也会拥有一系列的特征标签,基因表达,神经元形态,投射信息和电生理特性等。为了更清晰地认知神经元世界的运作规则,更高分辨率的细胞分群信息在神经生物学内变得尤为重要。通过更高分辨率的手段获得的分群信息帮助我们捕获那些已知投射和功能的集团,更重要的是揭示出潜在的新细胞群体,更系统全面地揭示大脑的工作原理。fMOST及其配套的分析手段发展为我们提供了绘制大脑联接网络的可能性,与其他技术手段结合构建神经元类型标准框架,帮助揭示大脑功能。目前建立全脑神经元联接图谱库是世界各国打造全球脑科学中心的重要基础。现详细为大家分享fMOST技术是如何助力于脑科学研究的。
fMOST与多技术协作构建单神经元级别的全脑联接图谱
fMOST的一个主要用处在于构建全脑联接图谱,从而与多技术协作揭示高分辨率的神经元分群,帮助我们更好地阐释大脑发挥功能的单元。中国科学院脑科学与智能技术卓越创新中心严军研究组、徐宁龙研究组与华中科技大学苏州脑空间信息研究院、武汉光电国家研究中心龚辉团队合作在Nature Neuroscience 期刊以封面文章的形式在线发表了题为Single-neuron projectome of mouse prefrontal cortex(小鼠前额叶单细胞投射谱)的研究论文,其中很好地展示了fMOST技术的这一应用。
前额叶皮层在决策、工作记忆、注意力等高级认知功能中扮演重要角色,其结构和功能的异常会导致多种脑疾病。其投射范围很广,几乎覆盖大部分脑区,包括皮层、纹状体、丘脑、中脑和后脑等。这篇文章使用自主开发的Fast Neurite Tracer (FNT)光学成像大数据神经元追踪及分析软件,系统性地重构了小鼠前额叶皮层6357个单神经元全脑投射图谱,建立了国际上最大的小鼠全脑介观神经联接图谱数据库(图 A);揭示了小鼠前额叶皮层内64种神经元投射亚型的空间分布规律,发现不同群之间存在不同的投射特征(图B);阐明了前额叶内部模块化的连接网络和等级结构(图C)。在构建全脑联接网络的同时,研究人员也致力于与多技术协作建立一个能够整合多种分子空间遗传信息与多方面表型性质的标准化神经元分型框架。该文章整合了神经环路与转录组细胞类型的联系。通过逆向示踪和荧光原位杂交技术获得神经元转录组亚型与投射亚型的对应关系(图D)。以往的研究利用群体示踪技术来研究前额叶皮层神经元的全脑投射模式,并不能很好地解析前额叶脑联接网络的工作模式和等级结构。通过fMOST 技术实现的单细胞水平成像帮助揭示了前额叶皮层内部连接和外部投射的规律,并提出了前额叶皮层可能的工作模型。
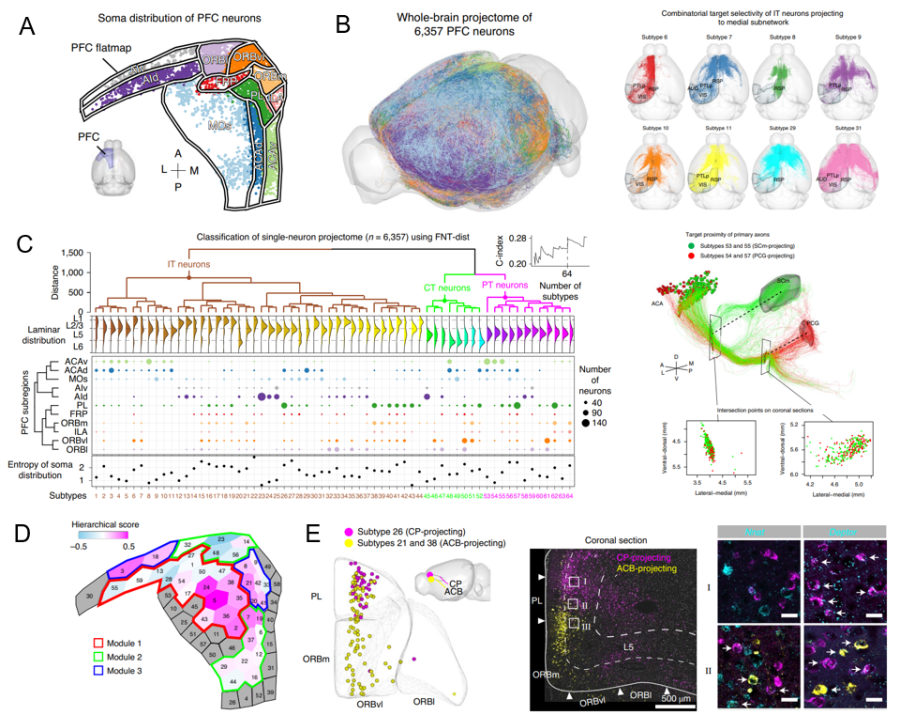
(A)重构mPFC神经元在脑内空间分布。(B)mPFC全脑轴突投射分布(右),几种具有不同投射选择性的神经元亚型(左)。(C)利用FNT 算法对单神经元投射图谱进行聚类分析的结果(左),两种差异性高亚型(SCm-projecting / PCG-projecting) 的三维重构结果(右)。(D前额叶内部连接网络的模块化和等级结构。(E)前额叶投射亚型与基因亚型的关系(CT皮层丘脑神经元在PL-ORB脑区)。
fMOST描绘精细神经元形态
单细胞水平的神经元精细结构解析能直观的揭示神经元特性。fMOST可以在极高的分辨率下重构神经元形态,观察神经元的精细结构。武汉光电国家研究中心骆清铭教授率领的MOST团队与美国冷泉港实验室黄佐实教授(Prof. Z. Josh Huang)课题组合作在Cell Reports发表的题了为Genetic Single Neuron Anatomy Reveals Fine Granularity of Cortical Axo-Axonic Cells(遗传单神经元解剖学揭示皮层轴突-轴突细胞的精细结构)的文章,开发了fMOST在这一方面的具体应用。
在该文章中,研究者们设计了一种基于fMOST成像的,适用于遗传特异标记的单细胞解剖学结构精准研究平台(genetic Single Neuron Anatomy platform, gSNA)。通过解决单细胞遗传标记、全脑精准成像、神经元重构和定量分析这四个方面的难点,实现了对AAC(Axo-Axonic Cells)细胞全脑单细胞尺度的解析。对全脑多个脑区的AAC细胞进行系统性的单神经元重建,发现AAC细胞的胞体位置、树突和轴突纤维的空间分布模式不是随机的,而是与大脑皮层分层相关。通过综合大量重构细胞数据,利用合理定量手段及聚类分析对细胞分型,发现AAC细胞存在多种亚型。该研究全面的利用定量和定性手段解析了AAC细胞的形态学分型,更新了人们对AAC细胞的认知,有助于对AAC细胞的进一步理解和功能揭示。
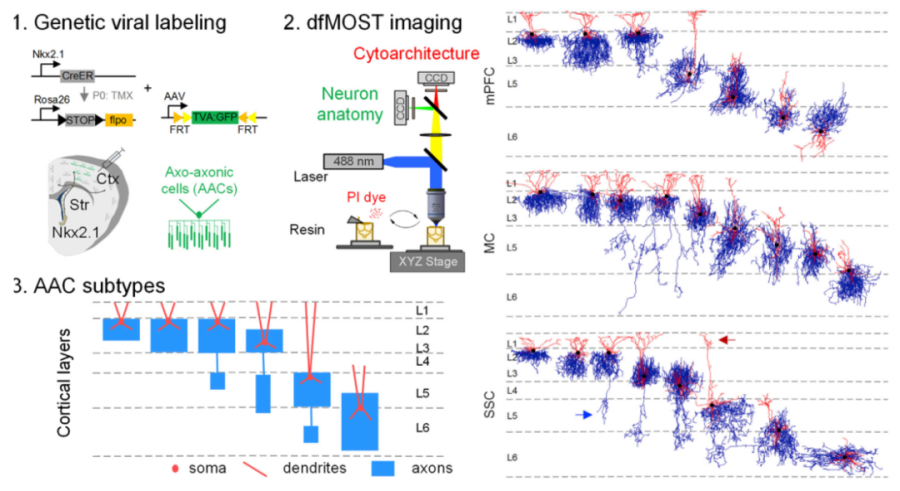
技术路线及皮层内AAC亚群分类结果
工欲善其事,必先利其器。生命科学的每一次发展,都以重大技术的进步为前提。fMOST技术为脑科学的发展做出了重大贡献,极大推进了对大脑结构和功能的理解,从“看”得见,到“看”得清、“看”得懂。与现在使用的fMOST成像技术相比,电镜可以很好地重构纳米级分辨率的细胞微小结构,提供接近真实的细胞间联接的状态,完整的纳米级/突触分辨率的联接图谱提供了对环路有贡献的所有信息。这些知识可用于揭示正常和病变状态下环路特征并构建环路模型、识别功能相关的关键神经元,以及基于远程连接和超微结构形态发现新的细胞类型。对秀丽隐杆线虫和果蝇等模式生物的研究已经证明全脑联接谱在支持神经环路深入研究方面的潜力。但是目前电镜技术只能重构~1 mm3大小的结构,而小鼠大脑总体级约500 mm3,人的大脑则有小鼠的1000倍大。同时也对后续的数据分割、处理、存储,运算等方面的技术水平要求大幅提高。但毫无疑问,获得纳米级的神经元联接谱数据将在神经领域引起颠覆性的改变,也是后续脑图谱绘制的发展目标之一。图谱计划的完善将奠定神经科学领域的基础。覆盖全脑范围的联接谱以及精确的胞间联接结构绘制将彻底改变脑功能研究方式,从专注于假设驱动的研究到旨在阐明功能环路的基本规则的大型团队协作项目。这些进展将为发现脑疾病相关的新环路机制奠定基础,帮助解决脑疾病难题。
参考文献:
1. Abbott L F, Bock D D, Callaway E M, et al. The mind of a mouse[J]. Cell, 2020, 182(6): 1372-1376.
2. Li A, Gong H, Zhang B, et al. Micro-optical sectioning tomography to obtain a high-resolution atlas of the mouse brain[J]. Science, 2010, 330(6009): 1404-1408.
3. Gong H, Zeng S, Yan C, et al. Continuously tracing brain-wide long-distance axonal projections in mice at a one-micron voxel resolution[J]. Neuroimage, 2013, 74: 87-98.
4. Yang T, Zheng T, Shang Z, et al. Rapid imaging of large tissues using high-resolution stage-scanning microscopy[J]. Biomedical optics express, 2015, 6(5): 1867-1875.
5. Gong H, Xu D, Yuan J, et al. High-throughput dual-colour precision imaging for brain-wide connectome with cytoarchitectonic landmarks at the cellular level[J]. Nature communications, 2016, 7(1): 1-12.
6. Zhong Q, Li A, Jin R, et al. High-definition imaging using line-illumination modulation microscopy[J]. Nature Methods, 2021, 18(3): 309-315.
7. Gao L, Liu S, Gou L, et al. Single-neuron projectome of mouse prefrontal cortex[J]. Nature Neuroscience, 2022: 1-15.
8. Wang X, Tucciarone J, Jiang S, et al. Genetic single neuron anatomy reveals fine granularity of cortical axo-axonic cells[J]. Cell reports, 2019, 26(11): 3145-3159.
作者:中国科学院脑科学与智能技术卓越创新中心 杜赟 王秋淼
 附件下载:
附件下载: